Bảng Nguyên Tử Khối Của Ba Ri, Bảng Nguyên Tử Khối Hóa Học Đầy Đủ Nhất
O 3 2– II Silicat t/kb T T – K K K K – K – K K K PO 4 3– III Photphat t/kb T T K K K K K K K K K K K những gốc axit khác tên thường gọi Hoá trị các gốc axit khác Tên goi Hoá trị Br – Bromua I HSO 4 – Hiđrosunfat I I – Iotua I HSO 3 – Hiđrosunfit I Mn
O 4 – Permanganat I HCO 3 – Hiđrocacbonat I Al
O 2 – Aluminat I H 2 PO 4 – Đihiđrophotphat I Zn
O 2 2– Zincat II HPO 4 2– hiđrophotphat II một số công thức tính hay được sử dụng 1. Tính số mol: + khi cho cân nặng chất: n = m M ( mol); Khi cho thể tích hóa học khí: n = 22,4 v ( mol); Khi đến C M , Vlit dung dịch: n =C M .V ( mol); khi cho cân nặng dung dịch, nồng độ phần trăm: n = % dd . .100% C m M ( mol) 2. Tính khối lượng: m= n.M( gam); trọng lượng chất tan: m ct = % dd . 100% C m ( gam); 3. Tính nồng độ: nồng độ C%= dd ct m m .100%; tính độ đậm đặc mol của dung dịch: C M = n V ( M) ( nhớ thay đổi V ra lit) . BẢMỘT SỐ NGUYÊN TỐ HOÁ HỌC Số p Tên nguyên tố ký kết hiệu hoá học tập Nguyên tử khối Hoá trị 1 Hiđro H 1 I 2 Heli He 4 3 Liti Li 7 I 4 Beri Be 9. 201 I,II 82 Chì Pb 207 II,IV ( Chú ý: chữ in đậm là nguyên tố kim loại, Chữ in nghiêng là nguyên tố phi kim) BẢNG HOÁ TRỊ CỦA MỘT SỐ NHÓM NGUYÊN TỬ Tên đội Hoá trị Tên đội Hoá trị Hiđroxit (-. Cần sử dụng 1. Tính số mol: + khi cho khối lượng chất: n = m M ( mol); Khi cho thể tích chất khí: n = 22,4 v ( mol); Khi mang lại C M , Vlit dung dịch: n =C M .V ( mol); khi cho khối lượng dung dịch, nồng
Nguyên tử khối là gì? Bảng nguyên tử khối hóa học của Brom, Ag, Bari, Kali, Zn, Crom, Ag, Nitơ, Iot, Mg, Mn, Bạc, photpho, Ba, Pb, Canxi, Clo, Silic…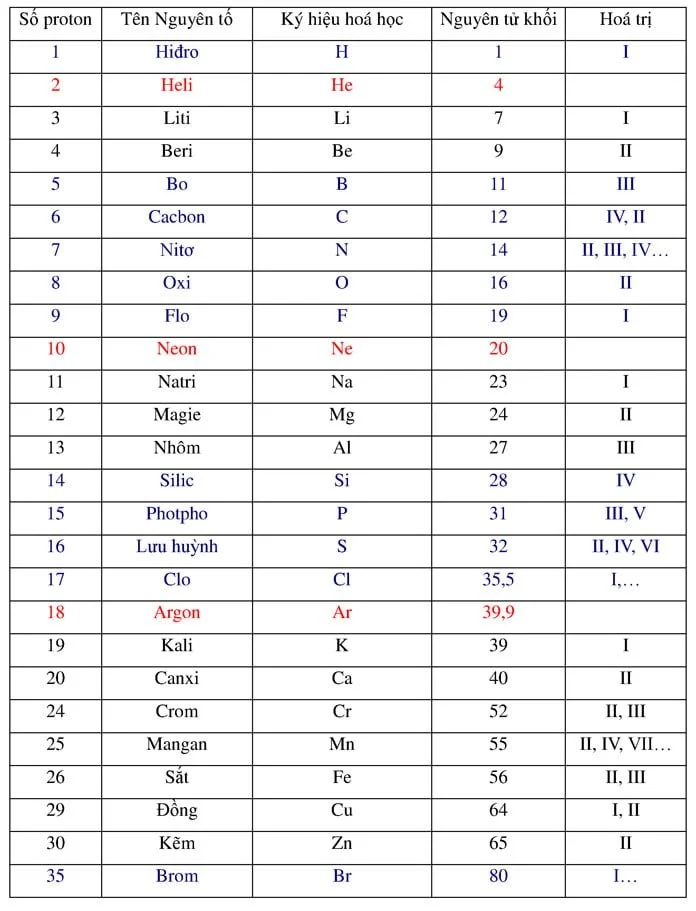
Nguyên tử khối là gì?
Nguyên tử khối của một nguyên tử là trọng lượng tương đối của một nguyên tử yếu tắc đó, là tổng của trọng lượng electron, proton với notron, tuy nhiên do khối lượng electron rất nhỏ nên thường xuyên không được tính, do vậy hoàn toàn có thể nguyên tử khối dao động số khối của phân tử nhân.
Bạn đang xem: Nguyên tử khối của ba
Hay đơn giản dễ dàng hơn là:
Nguyên tử khối là trọng lượng của một nguyên tử tính bằng đơn vị chức năng cacbon. Nguyên tố không giống nhau thì nguyên tử khối cũng khác nhau.
Ví dụ: Nguyên tử khối của Nitơ (N) = 14 (đv
C), của Magie (Mg) = 24 (đv
C).
Khối lượng nguyên tử
Đơn vị cân nặng nguyên tử là 1 đơn vị đo khối lượng cho trọng lượng của những nguyên tử với phân tử. Nó được quy cầu bằng 1 phần mười hai trọng lượng của nguyên tử cacbon 12. Vì đó, solo vị cân nặng nguyên tử còn gọi là đơn vị cacbon, ký kết hiệu là đv
C.
Nguyên tử khối trung bình
Hầu hết những nguyên tố hóa học là lếu láo hợp của đa số đồng vị cùng với tỉ lệ tỷ lệ số nguyên tử xác minh => nguyên tử khối của các nguyên tố có nhiều đồng vị là nguyên tử khối trung bình của lếu láo hợp những đồng vị bao gồm tính đến tỉ lệ xác suất số nguyên tử tương ứng.
Giả sử thành phần X tất cả 2 đồng vị A và B. Kí hiệu A,B đôi khi là nguyên tử khối của 2 đồng vị, tỉ lệ xác suất số nguyên tử khớp ứng là a cùng b. Lúc đó: nguyên tử khối vừa đủ
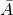
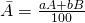
Trong gần như phép toán không bắt buộc độ chính xác cao, có thể coi nguyên tử khối ngay số khối.
Công thức tính khối lượng mol nguyên tử
Công thức và các bước tính cân nặng nguyên tửBước 1: yêu cầu nhớ 1 đv
C = 0,166 . 10-23 cách 2: Tra bảng nguyên tử khối của nguyên tố. Ví dụ điển hình nguyên tố A gồm nguyên tử khối là a, tức A = a. đưa sang cách 3. Bước 3: trọng lượng thực của A: m
A = a . 0,166.10-23= ? (g)
Tính số mol: + lúc cho trọng lượng chất: n = ( mol); Khi cho thể tích chất khí: n = ( mol)
Khi đến CM, Vlit dung dịch: n =CM.V ( mol); lúc cho khối lượng dung dịch, độ đậm đặc phần trăm: n = ( mol)
Tính khối lượng:: m= n.M( gam); cân nặng chất tan: mct= ( gam)
Tính nồng độ: nồng độ C%= .100%; tính nồng độ mol của dung dịch: CM= ( M) ( nhớ thay đổi V ra lit)
Bảng nguyên tử khối
| Số p | Tên nguyên tố | Ký hiệu hoá học | Nguyên tử khối | Hoá trị
|
| 1 | Nguyên tử khối của Hiđro | H | 1 | I |
| 2 | Nguyên tử khối của Heli | He | 4 | |
| 3 | Nguyên tử khối của Liti | Li | 7 | I |
| 4 | Nguyên tử khối của Beri | Be | 9 | II |
| 5 | Nguyên tử khối của Bo | B | 11 | III |
| 6 | Nguyên tử khối của Cacbon | C | 12 | IV, II |
| 7 | Nguyên tử khối của Nitơ | N | 14 | III,II,IV,.. |
| 8 | Nguyên tử khối của Oxi | O | 16 | II |
| 9 | Nguyên tử khối của Flo | F | 19 | I |
| 10 | Nguyên tử khối của Neon | Ne | 20 | |
| 11 | Nguyên tử khối của Natri | Na | 23 | I |
| 12 | Nguyên tử khối của Mg(Magie) | Mg | 24 | II |
| 13 | Nguyên tử khối của Nhôm | Al | 27 | III |
| 14 | Nguyên tử khối của Silic | Si | 28 | IV |
| 15 | Nguyên tử khối của Photpho | P | 31 | III, V |
| 16 | Nguyên tử khối của giữ huỳnh | S | 32 | II,IV,VI,.. |
| 17 | Nguyên tử khối của Clo | Cl | 35,5 | I,.. |
| 18 | Nguyên tử khối của Agon | Ar | 39,9 | |
| 19 | Nguyên tử khối của Kali | K | 39 | I |
| 20 | Nguyên tử khối của Canxi | Ca | 40 | II |
| 24 | Nguyên tử khối của Crom | Cr | 52 | II,III |
| 25 | Nguyên tử khối của Mangan | Mn | 55 | II,IV,VII,.. |
| 26 | Nguyên tử khối của Sắt | Fe | 56 | II,III |
| 29 | Nguyên tử khối của Đồng | Cu | 64 | I,II |
| 30 | Nguyên tử khối của Kẽm | Zn | 65 | II |
| 35 | Nguyên tử khối của Brom | Br | 80 | I,… |
| 47 | Nguyên tử khối của Ag (Bạc) | Ag | 108 | I |
| 56 | Nguyên tử khối của Bari | Ba | 137 | II |
| 80 | Nguyên tử khối của Thuỷ ngân | Hg | 201 | I,II |
| 82 | Nguyên tử khối của Chì | Pb | 207 | II,IV |
( Chú ý: chữ in đậm là thành phần kim loại, Chữ in nghiêng là yếu tố phi kim)
Download bảng nguyên tử khối vừa đủ pdf
Các bạn cũng có thể in bảng nguyên tử khối các chất để tiện cho câu hỏi theo dõi cùng tra cứu. giaoandientu.edu.vn cung ứng 1 bạn dạng pdf để cho các bạn có thể in ra được. – Bảng nguyên tử khối không thiếu các chất:









